2024年10月17日,清华大学药学院唐海东课题组在《Cell Reports》杂志上发表了题为“PD-L1 protects tumor-associated dendritic cells from ferroptosis during immunogenic chemotherapy”的研究论文。该研究揭示了PD-L1在免疫原性化疗期间对肿瘤相关树突细胞的保护作用,为癌症治疗策略的优化提供了新的视角。

癌症治疗中的化疗和免疫疗法一直是两种主要手段。化疗通过杀死快速分裂的癌细胞来抑制肿瘤,而免疫疗法则通过激活机体的免疫系统,增强其识别并攻击癌细胞的能力。尽管这些疗法在抗癌方面取得了一些成效,但其效果并不总是令人满意。为了提升治疗效果,研究人员一直在探索将这两种治疗手段结合起来的可能性,许多临床试验正在测试化疗与免疫疗法的联合应用,试图利用二者产生协同效应。然而,这些联合疗法并未在所有癌症患者中表现出理想的疗效,其背后的机制尚未完全阐明。
肿瘤微环境中的树突状细胞是连接先天免疫和适应性免疫的关键桥梁,能够捕捉抗原并激活肿瘤特异性T细胞,从而发起有效的抗肿瘤免疫反应。研究表明,在肿瘤微环境中,树突状细胞高表达免疫检查点分子PD-L1。PD-L1是癌症免疫逃逸的重要分子之一,通过与T细胞表面的PD-1结合抑制免疫应答。然而,PD-L1在树突状细胞中的生理功能以及它在化疗中的作用却不甚明确。
本研究聚焦PD-L1在免疫原性化疗中的作用及其机制。研究发现,在PD-L1缺失的情况下,树突状细胞对化疗药物更加敏感,易发生铁死亡(ferroptosis),这是一种依赖铁的细胞程序性死亡方式,通常伴随脂质过氧化物的积累。铁死亡的发生导致树突状细胞数量减少,从而削弱了机体的抗肿瘤免疫应答。分子层面的实验揭示了PD-L1的作用机制:PD-L1通过调节SLC7A11(一种关键的抗氧化分子)的表达,抑制脂质过氧化物的累积,防止树突状细胞发生铁死亡。PD-L1的缺失导致SLC7A11表达下调,脂质过氧化水平上升,从而增强了化疗药物对树突状细胞的细胞毒作用。此外,在PD-L1缺失的小鼠中,研究人员观察到肿瘤特异性T细胞的激活显著下降,表明PD-L1对树突细胞存活及其抗原递呈功能至关重要。在进一步的临床研究中,研究人员还发现癌症患者树突细胞上PD-L1的表达水平与其接受免疫原性化疗后的治疗效果存在显著相关性。这一观察提示,PD-L1不仅在抗肿瘤免疫反应中发挥重要作用,其表达水平还可能成为预测患者化疗反应的生物标志物。
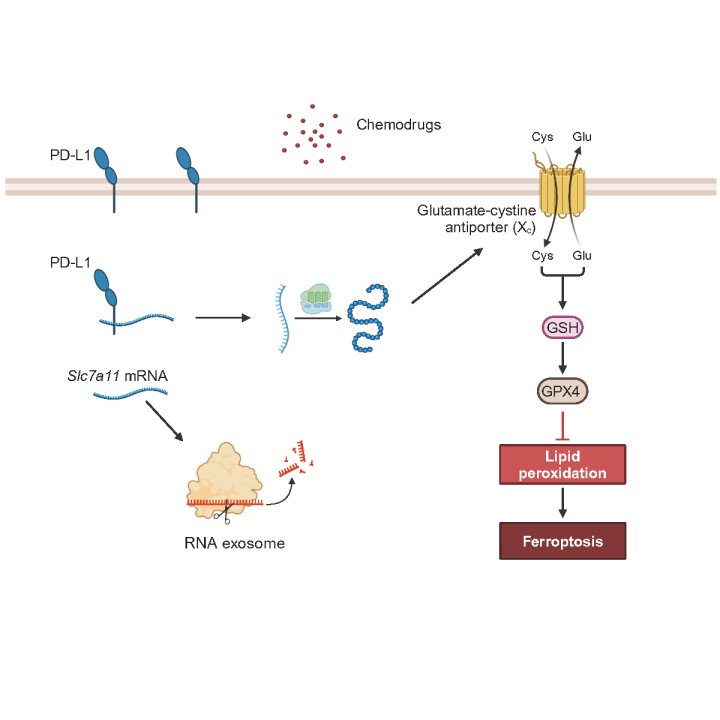
图1:在树突状细胞中,PD-L1保护Slc7a11 mRNA免于降解,从而防止细胞发生铁死亡
本研究表明,PD-L1不仅作为经典的免疫检查点分子发挥作用,还可以通过抑制树突状细胞中的铁死亡,增强抗肿瘤免疫应答。PD-L1通过上调SLC7A11的表达,抑制脂质过氧化,保护树突细胞免受化疗药物的毒性影响。这一保护作用的缺失会导致树突细胞死亡,从而减弱肿瘤特异性T细胞的激活,最终削弱机体的抗肿瘤能力。本研究为PD-L1在癌症治疗中的多重功能提供了新的见解,揭示了它在保护免疫细胞免受化疗毒性影响方面的作用。未来,通过深入研究PD-L1在不同类型肿瘤和治疗方案中的作用,可能会推动更为精确的联合治疗策略的发展。
清华大学药学院唐海东副教授为本文的通讯作者,清华大学药学院博士生肖恺民、张丝琳、彭琦(已毕业)、福建医科大学附属第二医院杜玉霞博士为本文的共同第一作者。清华大学博士生姚习悦、吴欣欣为本文提供了重要实验帮助。本课题得到了国家高层次人才计划青年项目、国家自然科学基金、科技部重点研发、清华大学“笃实计划”、生命科学中心等基金支持。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S2211-1247(24)01219-1
