清华大学药学院张数一课题组构建RPA系统维持干扰前后细胞内基因表达水平稳定
清华大学药学院
清华大学药学院张数一课题组构建
RPA系统维持干扰前后细胞内基因表达水平稳定
01
研究背景
从控制代谢途径的反馈回路到感应细胞对外部刺激的信号转导网络,自然界进化出多种策略来维持稳态,抵消外界波动和干扰。日常生活中,人们“入芝兰之室久而不闻其香,入鲍鱼之肆久而不闻其臭”就是一种感觉适应(图1A,B),即在外界持续刺激的情况下,生物体通过自身基因表达水平调控导致嗅觉神经元感受性降低,保持感知系统敏感和平衡。这种动态平衡不仅对正常生理功能至关重要,也为工程化新生物功能提供了灵感。此外,适应性合成生物系统在疾病治疗方面具有显著的潜力,可以在基因异常过表达或低表达时通过一系列反馈回路恢复稳态,并为治疗多种疾病如癌症、炎症和神经退行性疾病等开辟新的途径。
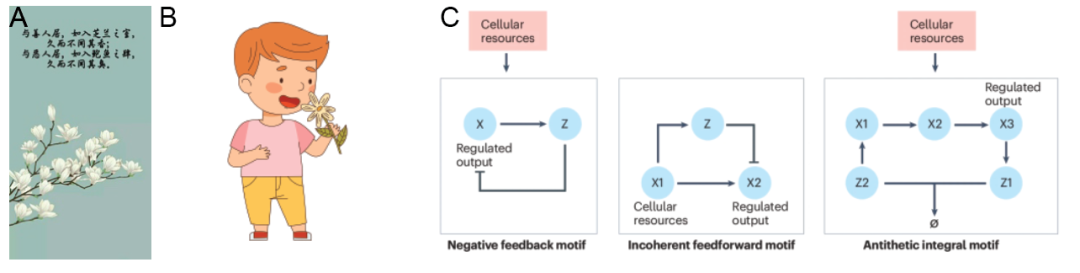
图1 生物体适应现象和适应性合成回路类型1,2
02
研究成果
2024年8月1日,清华大学药学院张数一团队在《Nucleic Acids Research》上发表了题为“CRISPR perfect adaptation for robust control of cellular immune and apoptotic responses”的研究文章。在这项研究中,作者构建并验证了哺乳动物细胞中的RPA系统,并应用于免疫细胞NF-κB通路和细胞凋亡通路,为内源基因表达异常的治疗提供新思路。

03
研究内容
1. 理论模型
目前广泛应用的两种适应性合成回路是前馈回路(iFFL)和负反馈回路(NFL)。然而在实际应用中两者均存在一定问题。最近,人们提出了一种更全面的反馈回路类型,即完美适应的调控网络(robust perfect adaptation,RPA)(图1C)。该系统的核心Z1和Z2两个元件,其中Z2可抑制Z1的表达。根据公式可得,目的基因Xn的浓度将收敛到μ/φ,不受内源通路或其他外界扰动影响,最终实现扰动前后输出信号表达水平一致(图2A,B)。首先,作者选择dCas9-VP64和AcrIIA4蛋白作为该系统的核心蛋白。(图2C)。实验结果表明,AcrIIA4强有力地抑制了dCas9-VP64介导的基因表达上调,证明两蛋白均可发挥相应功能。

图2 RPA系统理论模型
2. 实验验证
系统构建完成后,作者继续评估该系统在扰动前后的稳定性。实验设计了闭环回路,即RPA系统,和开环回路作为对照(图3A,B),并构建稳转细胞系,利用流式细胞术检测目的基因表达水平(图3C)。通过调节Dox和Shield-1的浓度,该系统可精确调控GFP即目的基因的表达水平。为描述动态响应曲线,实验从第0天(D0)开始培养这两种稳定细胞系,同时加入0.6 μM Shield-1和0.1 μM Dox,每24小时进行流式细胞术监测GFP荧光。在第3天(D3),将Shield-1浓度降至0.1 μM引入扰动,并继续监测(图3D)。研究结果表明,在闭环回路中,目的基因(GFP)的表达水平迅速恢复到基线,并长时间保持稳定,与对照组的显著下降形成鲜明对比(图3E)。

图3 哺乳动物细胞中的RPA系统的构建与验证
3. 场景应用
场景1 T细胞免疫基因表达调控
作者将该系统与内源NF-κB通路结合,将rtTA替换为内源NF-κB转录因子构建混合型系统(图4A),并通过NF-κB激动剂PMA/Ionomycin引入扰动(图4B),目的基因表达水平则通过构建表达NF-κB报告系统的细胞系表征。结果显示,相对于对照组,该系统在扰动前后可以稳定维持目的基因的表达(图4C)。

图4 RPA系统与内源NF-κB通路混合系统
场景2 细胞凋亡的空间控制
作者将该系统应用于控制细胞凋亡过程,用促凋亡蛋白BAX取代GFP(图5A)。实验将DD标签融合于BAX N端,通过调节Shield1浓度人为干扰细胞凋亡程度,模拟外界压力导致健康细胞异常凋亡(图5B,C)。实验构建了闭环和开环回路的稳定细胞系,其中闭环细胞同时表达GFP荧光,开环细胞同时表达BFP荧光。考虑到凋亡在自然界模式形成中的重要作用,作者尝试共同培养这两种细胞系来创建不同的凋亡模式。实验将开环回路细胞种于中央圆圈中,闭环回路细胞种于外周(图5D),最初用0 μM Shield-1和0.1 μM Dox处理24小时未观察到细胞凋亡,随后,用0.6 μM Shield-1和0.1 μM Dox继续处理24小时,结果显示开环回路细胞中观察到细胞凋亡,而闭环回路细胞未受到影响(图5D),表明RPA系统可以有效地在健康细胞中维持BAX的稳定表达而不影响邻近细胞。此外,通过调整Shield-1浓度,我们可以精确控制开环回路细胞的凋亡程度,实现不同程度的模式形成(图5E)。这些结果共同证明了RPA系统与凋亡机制相结合实现了对细胞生长和死亡的空间和时间控制。

图5 RPA系统调控细胞凋亡过程
04
研究结论
作者设计了基于dCas9-VP64和AcrIIA4的合成基因回路并进行验证,实现了哺乳动物细胞中完美适应系统的构建,维持扰动前后目的基因的稳定表达。此外,该系统通过设计sgRNA靶向内源转录因子(如参与T细胞NF-κB介导的免疫反应)与内源调控机制无缝整合,在响应环境刺激中实现了免疫细胞活动的精确和稳定调控;此外,该系统可编程细胞凋亡过程,实现细胞增殖和凋亡的人为控制。该系统在外部干扰中保持稳定基因表达水平的能力展示了其在生物应用中的稳健性,为治疗因基因表达异常造成的疾病提供了新的策略。
图源:
1 Di Blasi, R. et al. Understanding resource competition to achieve predictable synthetic gene expression in eukaryotes. Nature Reviews Bioengineering, 1-12 (2024).
2 图源网络
清华大学药学院张数一课题组2020级直博生张伊弛为该论文第一作者,清华大学张数一老师为论文通讯作者。感谢药学院廖学斌老师提供Jurkat细胞系。本研究得到国家自然科学基金,国家科技部重点研发计划,清华大学笃实专项基金和北京生物结构前沿研究中心的资助。
科学家小档案

张数一 清华大学药学院
2009年本科毕业于清华大学生物科学与技术系;2015年博士毕业于宾夕法尼亚州立大学;2015年至2019年在美国麻省理工学院进行博士后研究;2019年加入清华大学药学院。目前任清华大学药学院副教授,博士生导师,清华大学合成与系统生物学研究中心PI,分子肿瘤学全国重点实验室PI。入选国家高层次人才计划青年项目。长期致力于合成生物学和关键生命过程的研究,相关论文发Science,Nature Biotechnology,Nature Microbiology等国际学术期刊,有些研究成果已经改写世界经典教科书。目前课题组侧重在优良元件的计算机辅助从头理性设计、自动化平台赋能的高通量表征、连续定向进化系统辅助的快速精准优化等,以及将这些设计和改造后的元件有机耦合基因线路和调控网络,从而实现对生命的重构理解和认知,并有效地应用于疾病诊断和治疗等领域。
