二甲双胍是临床治疗糖尿病的一线用药,它主要通过表达于肝脏的细胞的有机阳离子转运蛋白OCT1进入肝脏细胞,激活AMPK信号通路,抑制肝糖原的输出。近期研究表明二甲双胍在心血管保护、抗肿瘤和抗衰老中也发挥显著作用。二甲双胍转运蛋白OCT1在肝脏摄取带有正电的内源性和外源性有机阳离子过程中起着核心作用,它不仅影响代谢过程,还对药代动力学和药效动力学有着重要影响。在2023年Seok-Yong Lee组,和Alastair G. Stewart组分别解析了引入热稳定性突变的OCT1/2cs向外开口和人源有机阳离子转运蛋白(hOCT1)向内开口的构象的冷冻电镜结构信息。但是目前仍然缺乏hOCT1底物转运过程中完整构象变化的结构信息,来揭示底物转运与构象重排的分子机理。
2024年3月15日,清华大学药学院刘翔宇课题组、陈立功课题组与生命科学学院闫创业课题组联合在《细胞发现》(Cell Discovery)发表了题为“Structural insights into human organic cation transporter 1 transport and inhibition” (人源有机阳离子转运蛋白hOCT1转运与抑制的结构研究)的重要成果。该工作通过结构生物学和生物化学相结合的手段阐明hOCT1转运底物二甲双胍的机制,揭示了螺内酯及甾醇类小分子的抑制机制,为精准医疗的研究和靶向OCTs的药物设计奠定了基础。

在本研究中,作者报道了hOCT1结合底物二甲双胍向外开口(Outward open)、向外关闭(Outward occluded)、向内关闭状态(Inward occluded),结合纳米抗体Nb5660、底物不结合的三种不同的向内开口状态(Inward facing partially open 1.partially open 2 and fully open),以及结合抑制剂螺内酯开口朝向胞外和胞内构象(Outward facing and inward facing)的冷冻电镜结构,分辨率范围从2.98 Å至4.14 Å (图1)。
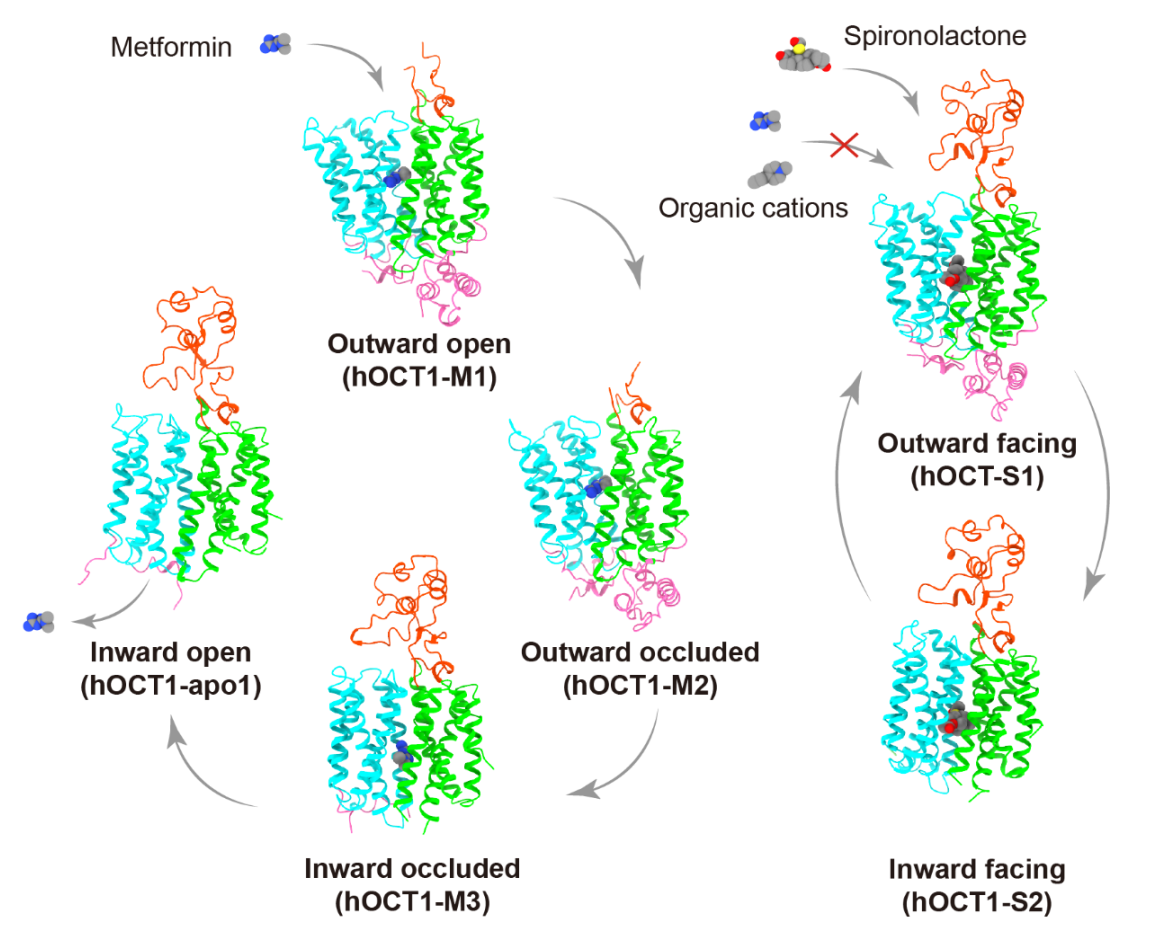
图1 hOCT1底物转运与抑制剂结合的结构信息
本研究通过冷冻电镜技术,解析了hOCT1与二甲双胍复合物在不同构象状态下的三维结构,观测到了hOCT1跨膜转运二甲双胍的全过程(图2)。结合放射性底物摄取实验,揭示了hOCT1介导有机阳离子跨膜转运的动态过程,并为阐明其抑制机制提供了直接的分子水平证据。在多构象的结构比对中,该研究总结出SLC22底物转运过程中,由YER motif参与的构象变化机制,并解释了部分由hOCT1基因多态性所引起底物转运能力降低的可能机制。此外,该研究通过解析临床上用于治疗水肿的螺内酯与hOCT1复合物的结构信息,结合底物转运抑制实验,揭示其底物转运抑制机理,同时分析了甾醇类分子抑制OCTs的共同规律与差异。对于药物-药物相互作用、药代动力学与药效动力学的研究提供了重要的基础数据。
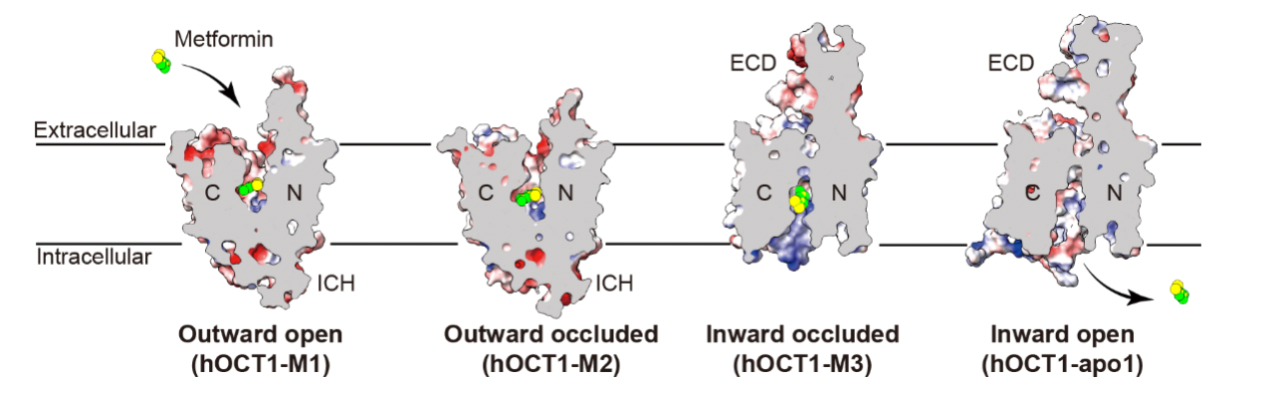
图2 hOCT1跨膜转运二甲双胍的过程
清华大学药学院刘翔宇研究员、陈立功研究员与生命科学学院闫创业研究员为本文共同通讯作者。清华大学药学院博士生张书豪为本文的第一作者。清华大学冷冻电镜平台与水木未来冷冻电镜平台为冷冻电镜数据收集提供了帮助。
本课题的计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持,生化实验的工作得到清华大学同位素实验室和清华大学晶体学平台的支持。本研究获得了生物结构前沿中心中心、生命科学联合中心,国家自然科学基金委的支持;并且还得到了中国科学技术部国家重点研发计划的资助。
原文链接:https://www.nature.com/articles/s41421-024-00664-1
